Randomização nos Ensaios Clínicos

Nos ensaios clínicos randomizados, idealmente os pacientes deveriam ser alocados de modo aleatório aos grupos de tratamento, para:
-
evitar a introdução de vieses:
-
distribuir os fatores prognósticos igualmente entre os grupos de tratamento.
A randomização controla a seleção dos pacientes e o viés de avaliação dos médicos e de outros participantes do estudo. Os estudos sem seleção randômica dos pacientes tendem a mostrar efeitos maiores com maior frequência do que os ensaios randômicos, e muitas vezes esses efeitos são positivos.
A randomização tem a desvantagem de depender da sorte para que ocorra uma distribuição estatística igual dos fatores prognósticos entre os grupos experimental e de controle.
A prática comum de atribuir valores de p às diferentes características dos grupos na linha de base é inapropriada (Bigby e Gadenne, 1996), já que valores não significativos são esperados devido à própria randomização. Em vez de descrever valores de p, devemos examinar cuidadosamente as diferenças existentes naquelas variáveis que possam ter impacto prognóstico.
Um exemplo de diferenças que não foram consideradas estatiticamente significativas entre os grupos, mas que poderiam ter importante impacto prognóstico, pode ser encontrado no artigo de Fentiman e colaboradores (Fentiman, Rubens e Hayward, 1983). Esses autores compararam o uso de mustina e talco no manejo de derrames pleurais em pacientes com câncer de mama e concluíram que o talco seria superior. Entretanto, observando a tabela das características da doença nos dois grupos, vemos que as pacientes que receberam mustina tinham doença em estágios mais avançados (3 e 4) e desenvolvimento mais precoce do derrame pleural. Não obstante, os autores se contentaram em relatar que as diferenças não foram estatisticamente significativas e consideraram os grupos comparáveis:
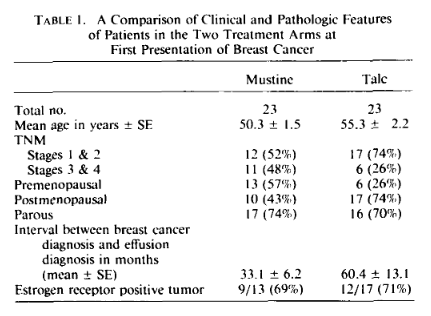
O mais importante, portanto, é avaliar o possível impacto que as diferenças de características clínico-patológicas entre os grupos, na linha de base, possa ter nos resultados do estudo.
Estratégias para garantir distribuição homogênea dos fatores prognósticos
Algumas estratégias podem ser úteis na tentativa de garantir que haja uma distribuição homogênea dos fatores prognósticos:
-
parear pacientes em termos de características demográficas e estágio da doença e então randomizar um membro de cada par aos diferentes grupos experimentais;
-
construir blocos de pacientes com características comparáveis e então realizar, dentro de cada bloco, a seleção randômica e em números iguais de pacientes para as diferentes alternativas de tratamento.
Estas estratégias visam assegurar que:
-
importantes fatores prognósticos sejam distribuídos igualmente nos grupos de pacientes comparados;
-
números aproximadamente iguais de pacientes recebam cada tratamento;
-
as vantagens da randomização sejam mantidas.
O desenho de randomização em blocos é especialmente útil nos estudos multicêntricos.
Métodos de randomização
O método de randomização utilizado nos estudos controlados deve ser relatado sempre. O método mais aceito é aquele que utiliza números obtidos de tabelas de números aleatórios geradas por computadores: os pacientes recebem um número aleatório após serem incluídos no estudo; o número foi previamente designado a um determinado grupo experimental e essa alocação é desconhecida tanto pelo paciente quanto pelo examinador. Entretanto, o que vemos é que frequentemente deixam de ser realizados os procedimentos corretos de randomização e de ocultação da alocação nos estudos publicados; mais ainda, muitas vezes os métodos de randomização utilizados não são descritos!
Métodos de randomização que podem introduzir vieses:
Algumas vezes, por conveniência, alguns pesquisadores utilizam métodos de randomização não recomendados para fazer a “randomização”:
-
por equipe de recrutadores de pacientes;
-
de acordo com dias pares ou ímpares de entrada no estudo;
-
por datas de nascimento;
-
por número do documento nacional de identificação;
-
por dia da semana;
-
por lançamento de moedas;
-
por sorteio.
Cegamento do tratamento e avaliação cega do desfecho
Os procedimentos de cegamento são especialmente importantes quando a avaliação dos desfechos é subjetiva. O cegamento dos pacientes e avaliadores assegura que os cuidados gerais e as avaliações de desfecho sejam igualmente aplicadas aos grupos experimentais e controles. Entretanto, o cegamento nem sempre é possivel, como por exemplo no caso de:
-
estudos de dietas diferentes;
-
tratamentos que modificam a cor da pele;
-
tratamentos com outros efeitos colaterais típicos.
Nesses casos, o rigor na avaliação estatística deve ser maior, levando em conta a possibilidade de vieses.
Avaliação do desfecho
As medidas das variáveis que definem o desfecho devem ser:
-
claramente definidas;
-
tão objetivas quanto possível;
-
ter significância clínica e biológica.
Os melhores índices são escalas que reflitam fielmente o estado da doença e que já tenham sido validadas em estudos prévios. Na ausência de escalas, as variáveis de desfecho mais simples e objetivas são as melhores:
-
morte e sobrevivência;
-
pacientes com e sem recaídas;
-
pacientes curados e não curados.
Podem ser criadas escalas para desfechos que sejam mais subjetivos por natureza, de preferência escalas ordinais simples. Essas escalas devem:
-
envolver um mínimo de subjetividade;
-
ter uma precisão bem mais fina do que as diferenças que estão sendo estudadas;
-
ser suficientemente padronizadas e reprodutíveis.
As variáveis devem ter clara significância clínica e biológica. Imaginemos, por exemplo, um ensaio terapêutico de pacientes com acne severa, que tenha relatado uma redução de um número médio de lesões de 300 para 250. Isso pode significar que em alguns pacientes a pele limpou completamente, enquanto em outros a pele ficou sem alterações ou a acne até piorou. Também pode significar que todos os pacientes melhoraram um pouco (Bigby e Gadenne, 1996). Mais ainda: será que um paciente tem um aspecto melhor quando o número de lesões cai de 400 para 350? Houve menos formação de cicatrizes e menos complicações?
O número de variáveis de desfecho deve ser pequeno e estas devem ser escolhidas antes do início do estudo. É importante enfatizar que um número grande de variáveis aumenta a chance de detecção de diferenças espúrias.
Cuidado com as variáveis substitutas de desfecho (surrogate variables)
Muitas vezes os estudos utilizam resultados de análises laboratoriais e outros parâmetros fisiopatológicos como substitutos para desfechos clínicos; avaliam, por exemplo, índices de linfócitos CD4/CD8 em pacientes com AIDS no lugar de desfechos clinicamente significativos, como sobrevida (Bigby e Gadenne, 1996). As variáveis substitutas de desfecho podem ser usadas, mas devem ter boa correlação com desfechos clínicos e a sua validade deve ter sido demonstrada em estudos prévios.
Exemplo do perigo de usar medidas substitutas de desfecho:
Após um infarto agudo do miocárdio, a administração de drogas antiarrítmicas resultou em menor ocorrência de despolarização ventricular anormal, mas em estudos randomizados controlados posteriores, o seu uso foi associado a mortalidade excessiva na comparação com placebo (Bigby e Gadenne, 1996).
Conclusão
A randomização realizada de modo adequado e a correta escolha das variáveis de desfecho são fundamentais para que os ensaios clínicos produzam resultados confiáveis. As diferenças entre os diferentes grupos de tratamento devem ser analisadas não apenas quanto à sua significância estatística, mas também quanto ao seu significado biológico e clínico.
Referências
Bigby, Michael, and Anne-Sophie Gadenne. 1996. “Understanding and Evaluating Clinical Trials.” Journal of the American Aca- demy of Dermatology 34 (4): 555–90.
Fentiman, Ian S., Robert D. Rubens, and John L. Hayward. 1983. “Control of Pleural Effusions in Patients with Breast Cancer a Randomized Trial.” Cancer 52 (4): 737–39.
