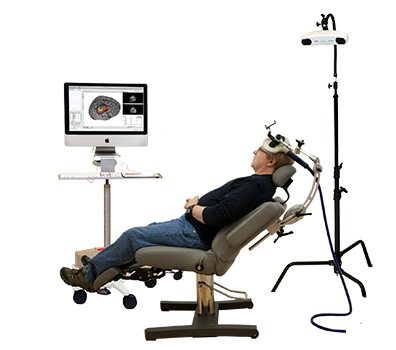
Coil positioning for TMS


Neurologista e Neurocientista


















Na era da medicina baseada em evidências, não há dúvidas de que as melhores fontes de informação sobre novos fármacos e terapias são as revisões sistemáticas de ensaios clínicos controlados randomizados. Entretanto, na prática a maioria dos médicos ainda utiliza outras fontes, tais como:
A seguir veremos como todas essas alternativas podem ser insuficientes.
Apesar de frequentemente utilizados por médicos, o seu valor é limitado, já que frequentemente contêm dados, números, texto e gráficos enganosos.
Wilkes, Doblin e Shapiro (1992) realizaram uma avaliação sistemática de 109 anúncios farmacêuticos publicados em revistas médicas. A maioria deles identificava, inapropriadamente, as drogas anunciadas como “superiores”, ou “de escolha”; apresentavam vieses e muitas citações inadequadas de estudos relevantes. Finalmente, muitas vezes traziam tópicos e gráficos enganosos.
Ziegler, Lew e Singer (1995) avaliaram sistematicamente a exatidão das informações sobre fármacos fornecidas pelos representantes de laboratórios em conferências médicas e verificaram que 11% das afirmações feitas eram inexatas. Simpósios médicos financiados pelos laboratórios são comumente publicados em muitas revistas boas e contêm muita informação sobre um único medicamento.
Segundo Bero, Galbraith e Rennie (1992), esses simpósios são menos frequentemente submetidos a revisão pelos pares, usam nomes comerciais das drogas, têm títulos enganosos e promovem indicações ainda não aprovadas para os novos fármacos.
Cursos de educação médica continuada são comumente financiados pela indústria farmacêutica e são uma fonte potencial de recomendações terapêuticas. Entretanto, esses cursos podem conter vieses favorecendo as medicações da empresa patrocinadora e podem afetar desfavoravelmente os padrões de prescrição dos médicos.
Apesar de muto citados e respeitados pelos médicos, os consensos de especialistas podem não fornecer as evidências mais recentes: Antman et al. (1992), citados por Bigby e Gadenne (1996) compararam metanálises de tratamentos para infarto agudo do miocárdio e recomendações em artigos de revisão sobre o tratamento agudo e a prevenção secundária do IAM. Em 5 de 6 ocasiões nas quais os dados publicados revelaram a eficácia de tratamentos para a redução da mortalidade no IAM, houve um atraso de vários anos antes que os especialistas consistentemente recomendassem essas terapias! Ou seja, a dependência estrita em recomendações de consensos de especialistas pode levar ao uso de terapêuticas antigas e à não utilização daquelas mais modernas e comprovadas.
Por mais vasta que seja a experiência pessoal de um único médico, ela invariavelmente sofrerá de:
memória seletiva: o profissional tende a lembrar dos pacientes que melhoraram, a considerar que os que não retornaram melhoraram e a -convenientemente- esquecer dos que não melhoraram.
compulsão de “evitar” o último desastre: suponhamos que um dermatologista tratou uma paciente com minociclina para acne e ela teve séria reação de hipersensibilidade. Após esse episódio, ele passou a evitar prescrever minociclina para acne, apesar de saber que esse tipo de reação não é frequente.
falhas de documentação: poucos médicos mantêm registros adequados, facilmente consultados, dos resultados dos tratamentos; poucos tentam rastrear os pacientes perdidos para o follow-up.
“n” muito pequeno: um único médico vê muito poucos pacientes comparativamente à experiência mundial da literatura!
O papel da FDA e suas congêneres (inclusive a nossa ANVISA) é de assegurar que os fármacos sejam eficazes para as indicações da bula, tenham benefícios que superem os riscos, sejam de alta qualidade e tragam orientações de uso completas e honestamente comunicadas.
Entretanto, esses órgão apresentam diversas limitações: algumas medicações e procedimentos acabam sendo aprovados com base em um único ensaio clínico multicêntrico controlado e ocorrem pressões da indústria e de alguns governos para facilitar e agilizar o processo de introduzir novas drogas, aparelhos e agentes biológicos. Além disso, após a aprovação muitas drogas passam a ser amplamente utilizadas para outras indicações!
Em última análise, a responsabilidade para determinar as indicações, a segurança e a eficácia dos fármacos que usa é do médico prescritor, e os ensaios clínicos controlados bem desenhados são a melhor forma de determinar os melhores tratamentos.




Os ensaios clínicos são fundamentais para o progresso da medicina. Entretanto, devemos estar atentos aos diversos erros e problemas que podem levar a conclusões equivocadas:
Para evitar isso, devemos partir do pressuposto de que a pergunta de pesquisa já foi respondida por algum autor
Dica: descobrir o que os pesquisadores anteriores acharam que poderia ser aprimorado
Dica: se não souber como definir esses critérios, tome como exemplo os critérios utilizados por outros pesquisadores
Dica 1: descrever os métodos de treinamento e calibração dos examinadores; descrever a variação entre examinadores
Dica 2: o processo de calibração dos métodos de medida pode até gerar um artigo em si mesmo
Dica: há programas online e comercialmente disponíveis que estimam o tamanho necessário para a amostra
blinding checks para evitar o Hawthorne effect
Dica: Os bons pesquisadores fazem uma tabela de Gannt e se mantêm fiéis a ela!
Dica: Muitos ensaios clínicos fracassam por não conseguir recrutar e manter os voluntários- fazer disso uma prioridade
” A sorte ajuda os bem preparados”
em pesquisa clínica, estar preparado significa ter um protocolo de pesquisa bem escrito, detalhado, que pode ser consultado frequentemente durante a pesquisa
é muito interessante ter a assessoria de um estatístico experiente antes da pesquisa e durante a análise dos dados
Dica: olhar os dados num gráfico- forma de sino?
Dica 1: os novatos geralmente excluem os voluntários perdidos da análise- isso pode alterar as conclusões do estudo
Dica 2: run-in phase - os pesquisadores vêem os voluntários mais de uma vez antes de começar o estudo- ajuda a estabelecer elegibilidade e reduz drop-outs
muitos softwares podem fazer esse cálculo
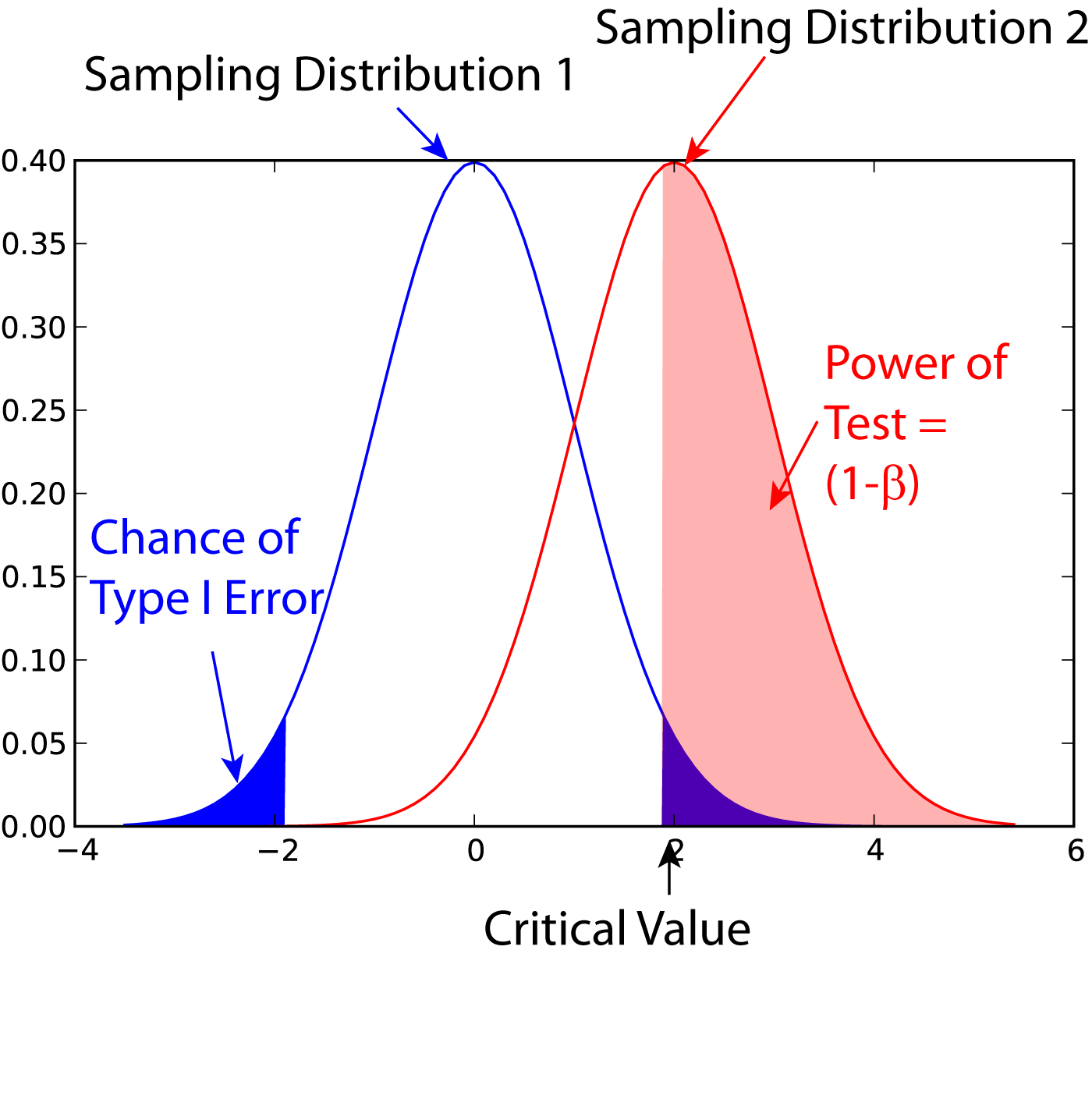
Estudos de equivalência com baixo poder estatístico tendem a erros do tipo II (falso negativo)
Causas de erro tipo II
um único estudo nunca prova que uma hipótese é verdadeira, ele simplesmente rejeita a hipótese nula
Fonte: Clark, G.T. and Mulligan, R., 2011. Fifteen common mistakes encountered in clinical research. Journal of Prosthodontic Research, 55(1), pp.1-6.




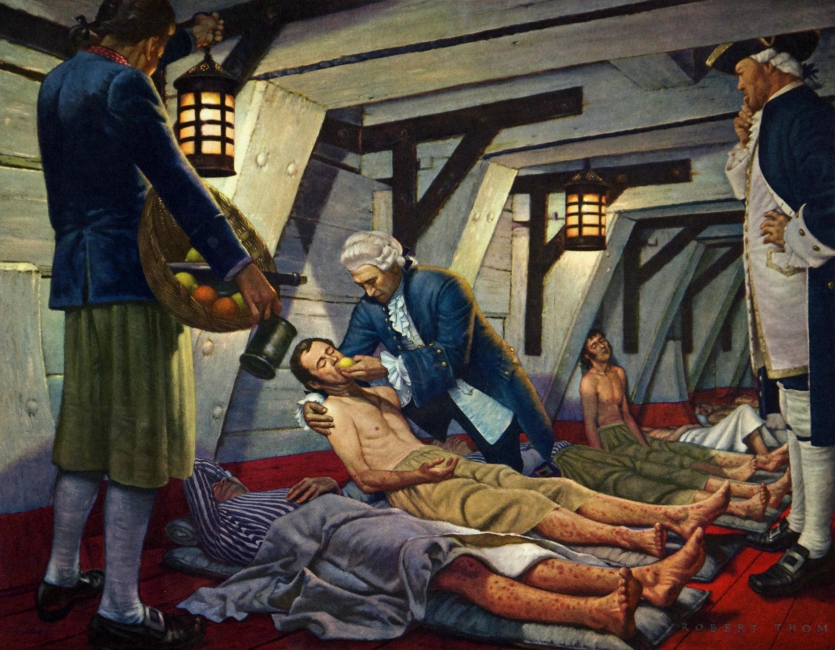
James Lind oferecendo uma laranja a um paciente com escorbuto. A History of Medicine in Pictures, Laboratório Parke-Davis, 1957
Um artigo recente publicado na revista Neuron revela um achado surpreendente e enigmático: os autores se depararam, por acaso, com uma paciente portadora de agenesia (ausência congênita) dos bulbos olfatórios, mas portadora de função olfativa inteiramente normal. A ressonância magnética funcional (fMRI) dessa paciente também mostrava ativação normal do córtex piriforme, que é o alvo primário dos estímulos olfatórios.













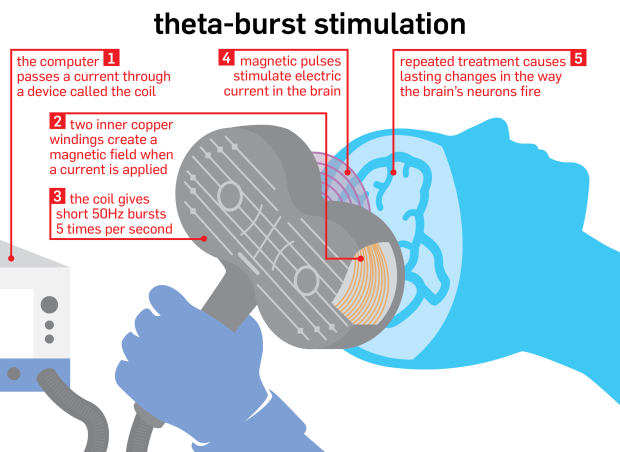
Ao realizarmos hoje um exame de eletroneuromiografia (ENMG) devemos nos lembrar de todo o esforço dos muitos neurofisiologistas e neurologistas que o tornaram possível!
Um trabalho publicado pelo historiador Herwig Czech na revista Molecular Autism lança dúvidas sobre o papel de Hans Asperger como um defensor das crianças portadoras de deficiências durante o regime nazista.
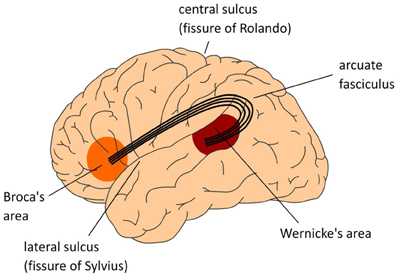

Um trabalho interessante foi publicado na revista PNAS. Um grupo de pesquisadores da Suíça, Inglaterra e Estados Unidos demonstrou experimentalmente que a estimulação transcraniana por corrente contínua pode aumentar a honestidade em humanos.